邁威生物靶向 Nectin-4 ADC 全球首次公布宮頸癌臨床數(shù)據(jù),展現(xiàn)優(yōu)異治療潛力
上海2024年3月18日 /美通社/ -- 邁威生物 (688062.SH),一家全產(chǎn)業(yè)鏈布局的創(chuàng)新型生物制藥公司, 2024 年 3 月 16 日于美國婦科腫瘤學(xué)會(huì) (SGO) 年會(huì)以聚焦全體會(huì)議口頭報(bào)告 (Focused Plenary Oral Presentation) 形式報(bào)告了 9MW2821 宮頸癌臨床研究數(shù)據(jù)。
此次公布的數(shù)據(jù)展現(xiàn)了其在宮頸癌領(lǐng)域的有效性及良好安全性,有望為復(fù)發(fā)或轉(zhuǎn)移性宮頸癌的治療帶來新的突破,滿足大量未被滿足的臨床需求。
9MW2821 是全球同靶點(diǎn)藥物中首個(gè)在宮頸癌適應(yīng)癥報(bào)道臨床數(shù)據(jù)的品種。
靶向 Nectin-4 ADC 治療復(fù)發(fā)或轉(zhuǎn)移性宮頸癌研究數(shù)據(jù)報(bào)告

該項(xiàng)多中心、開放、I/II 期臨床研究由復(fù)旦大學(xué)附屬腫瘤醫(yī)院張劍教授牽頭,本次由復(fù)旦大學(xué)附屬腫瘤醫(yī)院楊慧娟教授代表研究團(tuán)隊(duì)在大會(huì)做深入報(bào)告。研究結(jié)果獲得現(xiàn)場專家高度認(rèn)可。期待獲得更進(jìn)一步的臨床研究數(shù)據(jù),為復(fù)發(fā)或轉(zhuǎn)移性宮頸癌患者提供更多治療選擇。
楊慧娟教授現(xiàn)場報(bào)告
臨床結(jié)果
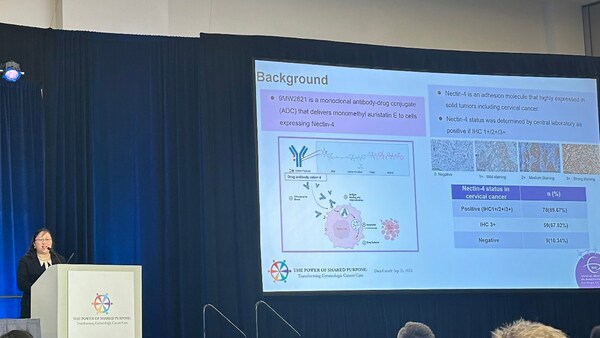
針對(duì)復(fù)發(fā)或轉(zhuǎn)移性宮頸癌的系統(tǒng)性治療藥物選擇和治療效果較為有限。9MW2821 的 I/II 期宮頸癌隊(duì)列納入含鉑雙藥化療聯(lián)合或不聯(lián)合貝伐珠單抗失敗、系統(tǒng)性治療方案不超過 2 線的復(fù)發(fā)或轉(zhuǎn)移性 Nectin-4 陽性宮頸癌患者。受試者在每 28 天為 1 個(gè)周期的第 1 天、第 8 天和第 15 天接受靜脈輸注 1.25mg/kg 的 9MW2821,直到確認(rèn)疾病進(jìn)展、死亡、無法忍受的不良反應(yīng)或退出研究。
截至 2023 年 9 月 25 日,該研究宮頸癌拓展隊(duì)列中,Nectin-4 表達(dá)的檢出率為 89.67%,Nectin-4 腫瘤細(xì)胞染色強(qiáng)度 3+(以下簡稱 "Nectin-4 3+")檢出率為 67.82%。該研究共入組 40 名患者,57.5% 受試者既往接受過含鉑雙藥化療聯(lián)合貝伐單抗治療, 60% 受試者既往接受過含鉑雙藥化療及免疫檢查點(diǎn)抑制劑治療。
有效性方面,37 例可評(píng)估療效的患者的 ORR 和 DCR 分別為 40.54% 和 89.19%,其中 1 例完全緩解 (2.70%),14 例部分緩解 (37.84%),中位無疾病進(jìn)展生存期 (PFS)、總生存期 (OS) 和緩解持續(xù)時(shí)間 (DOR) 尚未達(dá)到。Nectin-4 3+ 的患者中,26 例可評(píng)估療效的患者 ORR 和 DCR 分別為 50.00% 和 92.31%。經(jīng)過含鉑雙藥化療及免疫檢驗(yàn)點(diǎn)抑制劑治療的患者中,21 例可評(píng)估療效的患者 ORR 和 DCR 為 38.10% 和 85.71%。
安全性方面,92.50% 的受試者發(fā)生了與治療相關(guān)的不良事件,3/4 級(jí)治療相關(guān)不良事件中最常見的是中性粒細(xì)胞減少癥 (40.00%)、皮疹 (17.50%) 和γ-谷氨酰轉(zhuǎn)移酶增加癥 (12.50%)。沒有與治療相關(guān)的死亡報(bào)告。
上述研究結(jié)果表明,9MW2821 在宮頸癌患者中具有可控的安全性和積極的治療效果。















